立法院衛環委員會今天(20日)排審再生醫療雙法,其中備受關注的便是「附款許可」。衛福部長薛瑞元表示,考量病人能及早接受治療,只要再生醫療製劑完成臨床第二期試驗,並經審查風險效益具安全性及初步療效者,得附加附款,核予有效期間不超過5年的許可,期滿不得展延。
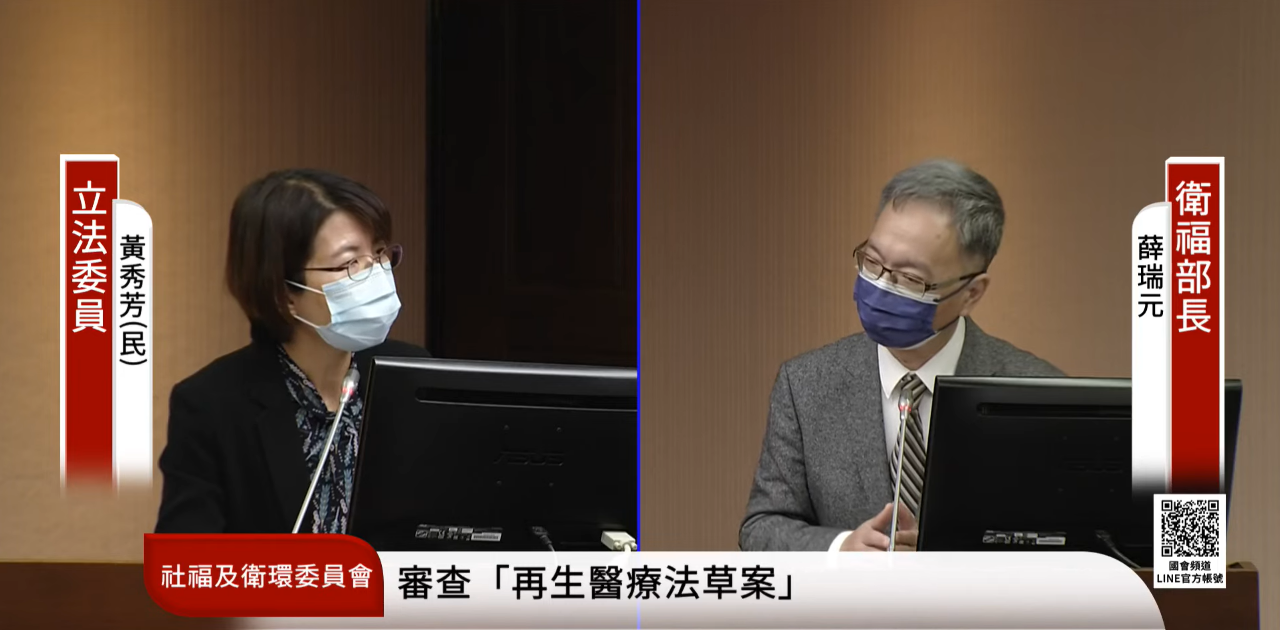
為推動再生醫療造福更多病人,衛福部制定「再生醫療法草案」與「再生醫療製劑條例草案」,已獲行政院核定,立法院衛環委員會20日排審再生醫療雙法。
衛福部長薛瑞元在會中說明草案重點,他指出,執行再生醫療屬醫療行為,執行場所以醫療機構為限,執行再生醫療的醫師應為該疾病相關領域專科醫師,並具備再生醫療相關知能;醫療機構執行再生醫療前,應向病人充分說明風險、效果與相關權利義務,經同意後才能執行,醫療機構應製作紀錄並至少保存15年。
醫療機構或受託機構執行細胞操作應確保人體組織、細胞來源提供者的合適性;細胞保存庫的設置應經中央主管機關許可,相關設置資格、費用、審查、退費、商業利用利益、回饋機制等事項將另訂辦法予以規範。為鼓勵產業發展、促進再生醫療臨床應用量能,將給予獎勵或補助。此外,為避免招募及再生醫療廣告氾濫或有不當宣稱,並考量再生製劑使用與執行風險較高,因此相關廣告採事前審查。
多名立委質詢時皆關切「再生醫療製劑條例草案」中的「附款許可」,薛瑞元表示,為顧及民眾能夠及早使用再生醫療製劑的權益,因此允許完成臨床二期的再生醫療製劑可申請附加附款及早上市,但有效期間不超過5年且不得展延。他說:『(原音) 國外他在做全球的臨床試驗的時候,台灣是只有可能是其中之一,有時候他只分配給台灣2個、3個,這2、3個如果進入到臨床試驗的計畫裡面的話,當然他可以免費,但是我們在等的病人可能是很多,所以,為了要讓我們的病人能夠早一點接受到這樣的治療,有機會可以接受到治療,所以我們用附款的方式,也就是說你做完二期的話,符合一定條件的,就可以先進來。』
薛瑞元強調,草案規定廠商若要申請附款許可,必須明定若發生問題時的補償機制,政府單位也會嚴格審查,若廠商做不到,會有一些處罰方式。
 用Podcast訂閱本節目
用Podcast訂閱本節目  Rti 中央廣播電臺
Rti 中央廣播電臺