國產疫苗二期臨床實驗結果還有待解盲,政府卻搶先簽約預定採購,安全性遭到外界質疑。指揮中心指揮官陳時中今天(31日)表示,國產疫苗做的是一、二期擴大試驗,尤其第二期收案人數超過4千人,比目前國際疫苗一、二期收案人數還要多,如果通過,安全性就不會有問題。
國產疫苗究竟安不安全,近來引發各界高度關注,不少人質疑為何二期試驗未解盲,政府就急著向廠商簽約預購。指揮中心指揮官陳時中31日例行記者會上拿出數據說明。

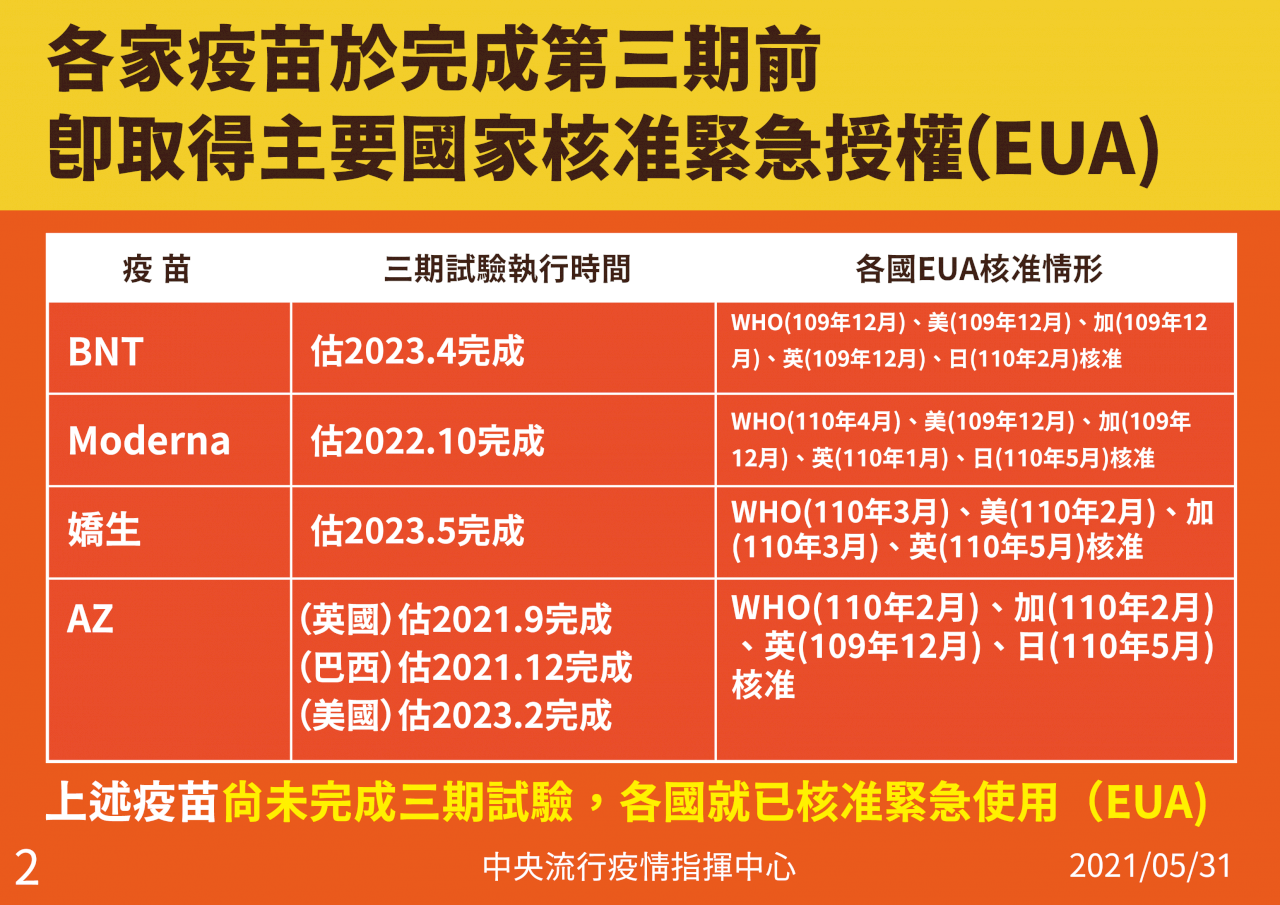
陳時中指出,比較國產疫苗和目前國際三大廠牌疫苗一、二期試驗收案人數,AZ第一、二期試驗人數3,220人;莫德納第二期試驗660人、BNT第二期試驗360人。
陳時中表示,國產疫苗在擴大二期收案人數超過4千人,規模超過莫德納、AZ或BNT疫苗一、二期受試人數,其中高端第一劑3,852人、第二劑3,815人;聯亞第一劑3,875人、第二劑3,844人。因此若國產疫苗二期通過,安全性不會有問題。陳時中:『(原音)我們這是一個擴大型的第二期,基本上也可以視為是一個二、三期延續的一個計畫,所以規模是很大,所以我才會講,就是說以這樣的規模,大家知道二期做的是安全性、那主要以這樣的規模,如果能夠通過的話,安全性就不會有問題。』
陳時中表示,要做完疫苗三期臨床試驗需要很長時間,如果做完三期再決定採購,恐怕緩不濟急,例如輝瑞疫苗完整第三期試驗結果估計2023年4月才能出爐,莫德納也要2022年10月,因此包括WHO、英國等國家大都在去年底或今年初就核准疫苗EUA(緊急授權使用)。
陳時中指出,很多國家早就在疫苗廠商取得EUA前就開始進行採購疫苗佈局,若等到EUA通過恐怕買不到貨,台灣也是,去年9月底就和Covax簽約,10底時和AZ簽約,當時AZ也還沒取得EUA;今年2月與莫德納簽約時,也只有英國通過EUA,WHO也是四月才通過,說明每個國家採購疫苗都是要提前佈局。
對於外界質疑政府護航國產疫苗是為了炒股,甚至有檢察官認為應該公布採購價格。陳時中表示,指揮中心與上市公司簽約都有保密條款,檢察官如果認為有需要了解相關價格可以訊問,但市場的事情與指揮中心無關。陳時中強調,指揮中心關心的是臨床試驗有無依照規格標準執行、解盲結果為何,作為核准EUA參考。
至於國人擔心國產疫苗未來恐無法經過國際認證,陳時中表示,目前國際對於是否採取疫苗護照尚未有共識,但台灣一定會持續爭取國產疫苗證明效力。
 用Podcast訂閱本節目
用Podcast訂閱本節目  Rti 中央廣播電臺
Rti 中央廣播電臺